tratamiento de reacciones alérgicas graves
Sanidad retira una de las inyecciones de adrenalina más vendidas del mercado
Algunas unidades del producto tienen un defecto, que hace que haya que realizar "una fuerza superior a la establecida" para activar la administración de la dosis
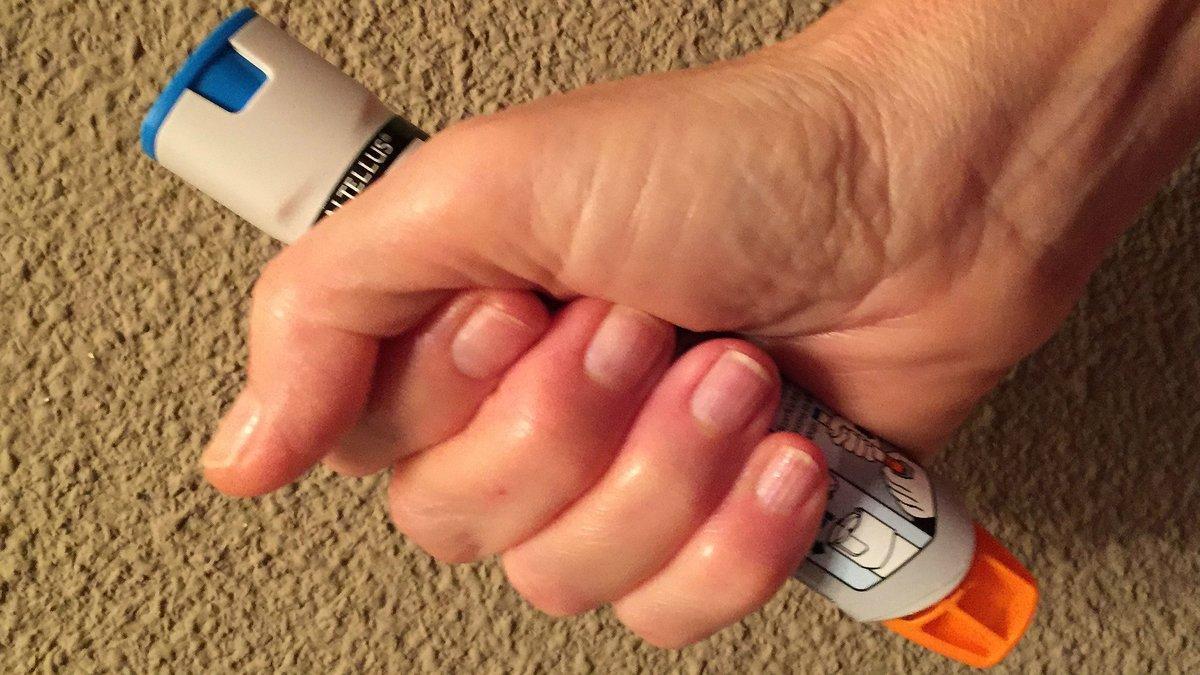
Un dispositivos de autoinyección de adrenalina / periodico
La Agencia Española de Medicamentos y Productos Sanitarios (Aemps) ha ordenado la retirada de la solución inyectable de adrenalina en pluma precargada Emerade, destinads al tratamiento de reacciones alérgicas agudas graves por un posible defecto de calidad.
Según una nota informativa de la AempsAemps, el defecto de calidad consiste en un problema con el dispositivo de autoinyección, que provoca que en algunas unidades haya que realizar "una fuerza superior a la establecida" en las especificaciones para activar la administración de la dosis.
Como consecuencia de ello, según la Aemps, existe el riesgo de que no se administre la dosis, un problema que no está asociado a lotes concretos, por lo que podría aparecer en cualquier pluma del fármaco.
"Dificultades" para su correcta administración
La Aemps asegura que, si bien la probabilidad de que una unidad esté afectada es baja, dadas las situaciones potencialmente muy graves en las que se administran "las dificultades inherentes a la administración en dichas situaciones clínicas, y que no administrar la dosis correspondiente supone un riesgo potencial para la vida del paciente", se ha ordenado la retirada del mercado.
No obstante, la Aemps destaca que la mayoría de las plumas Emerade que están en circulación se activarán correctamente con su uso y liberarán la adrenalina "de forma adecuada".
Para que los pacientes dispongan de medicamentos sin este defecto potencial, se sustituirán por otros alternativos.
- Barcelona, “decepcionada” y “preocupada” por que la Generalitat anuncie una desalinizadora flotante en el puerto sin avisarle
- García-Castellón y Gadea dejarán sus plazas en la Audiencia Nacional y Pedraz sopesa hacerse con el juzgado del Tsunami, por Ernesto Ekaizer
- El invierno vuelve por Sant Jordi: los meteorólogos alertan del fenómeno que nos espera la próxima semana en Catalunya
- El presidente del PP de Esplugues coló durante años facturas personales como gastos del partido para pagarlas con dinero público
- Airbnb aconseja a los propietarios que no anuncien las piscinas en sus alojamientos turísticos
- Vuelve Moisés a Pasapalabra: el concursante desvela los problemas que sufrió en el pasado y por los que tuvo que abandonar el programa
- DANA a la vista: estas serán las zonas más afectadas
- Sumergir los pies en vinagre, la nueva tendencia que arrasa: estos son sus beneficios